
|
|
COREPILE : Collecte et recyclage des piles et accumulateurs
|
| Définition et schéma d’une pile | |
| Histoire | |
| (Dossier pédagogique 1 : Construction, observation et fonctionnement d’une pile au citron) |
| Types et forme de piles | |
| Avantages et inconvénients desdifférents types de piles | |
|
(Dossier pédagogique 2 : éléctroquiz sur un vrai/faux autour des piles) |
| Le recyclage, pourquoi? | |
| Pourquoi y a-t-il eu du mercure dans les piles ? | |
| Le recyclage, comment ? | |
| La valorisation des divers composants des piles |
SENSIBILISER LES ENFANTS DE 3ÈMECYCLE À LA COLLECTE ET AU RECYCLAGE DES PILES USAGÉES
Chaque année en France, près de 800 millions de piles et de petits accumulateurs sont vendus, soit 30 000 tonnes (ce qui correspond à deux fois et demie le poids de la Tour Eiffel !). Malheureusement, encore trop peu sont collectés pour être recyclés : seulement 30 %. Et ceci, malgré un décret qui oblige depuis 2001 les consommateurs à rapporter leurs piles usagées à un point de collecte. Les enfants sont de gros consommateurs de piles : réveils, montres, voitures télécommandées, consoles de jeux vidéo, lampes de poche, lecteurs CD portables, brosses à dents électriques… Mais les piles usagées ne sont pas des déchets comme les autres. 87% des piles ne
sont pas classées dangereuses (comme par exemple les piles salines et alcalines), mais certaines piles boutons contiennent un faible pourcentage de
mercure, tandis que les accumulateurs nickel - cadmium et les
accumulateurs au plomb contiennent du cadmium et du plomb. Le recyclage des piles et accumulateurs permet de réutiliser les matières
premières qui les composent (manganèse, fer, nickel, zinc, cadmium, plomb, etc.). Une sensibilisation des enfants, futur écocitoyens, à la collecte et au recyclage des piles est indispensable aujourd’hui pour trois raisons :
• L’économie des ressources naturelles de métaux entrant dans la composition des piles : zinc, manganèse, cadmium… Récupérer ces
matières premières et les réintroduire dans le circuit de fabrication des piles et d’autres produits, c’est agir pour le développement durable.
• La diminution du volume des ordures ménagères, véritable enjeu écologique pour notre planète.
• Le risque potentiel de pollution lorsque les piles usagées sont rejetées dans la nature
Amener les enfants à réfléchir ainsi aux conséquences de leur mode de vie sur les ressources de la planète, l’environnement, les polluants, c’est faire un premier pas vers le développement durable qui a été défini comme "un développement qui s'efforce de répondre aux besoins du
présent sans compromettre la capacité des générations futures à répondre à leurs besoins."
Afin de faciliter une réflexion et une action collective, nous vous proposons un dossier d’information sur les piles, deux dossiers pédagogiques ainsi qu’un module ludique pour les élèves du
3e cycle.
Une pile est une réserve d’énergie transportable. Elle fabrique de l’électricité à partir d’une réaction chimique mettant en présence deux métaux différents plongés dans une solution conductrice.
Ces deux métaux, appelés électrodes, constituent les pôles de la pile.
Lorsqu’on branche la pile sur un appareil consommateur d’électricité, la solution conductrice (l’électrolyte) agit sur l'électrode négative (l'anode) qui cède des électrons. L'électrode positive (la cathode) capte les électrons. Le courant électrique consiste en la circulation de ces électrons !
Toutes les piles possèdent :
| Un pôle positif (la cathode) | |
| Un pôle négatif (l’anode) | |
| Un électrolyte conducteur, | |
| Une enveloppe métallique constituée de papier ou de plastique |
Schéma d’une pile alcaline au zinc/manganèse
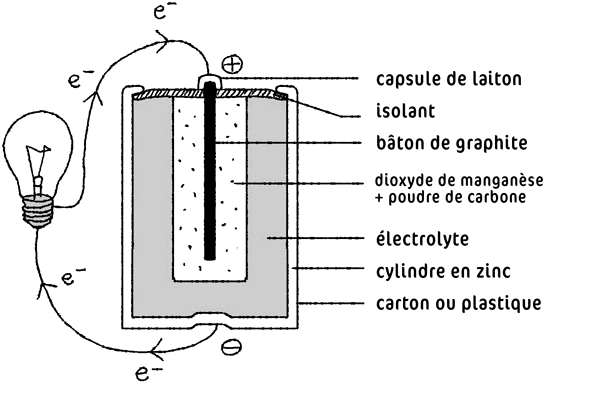
•Borne positive recouverte d’une capsule de laiton
•Borne positive composée d’un bâton de graphite
•Bioxyde de manganèse plus poudre de carbone
•Électrolyte
•Cylindre en zinc
•Borne négative en zinc
•Emballage en carton ou en plastique
À la borne négative, les atomes de zinc (Zn) sont transformés en ions zinc (Zn 2+), ce qui libère 2 électrons pour chaque atome.
À la borne positive, le bâton de graphite consommedes électrons. Cette libération et cette consommation d’électrons ont lieu simultanément, ce qui se traduit par un courant d’électrons par le circuit extérieur, passant par l’ampoule et permettant de l’éclairer.
Une pile dite « primaire » n’est pas rechargeable. La réaction chimique n’est pas réversible. Une fois que l’énergie a été
utilisée et la pile déchargée, il faut la rapporter dans un point de collecte afin qu’elle
soit recyclée (lieu de vente, supermarché, ou déchetterie…).
Une pile dite « secondaire » est rechargeable. Cette propriété n’est possible qu’avec certains couples éléctrochimiques: nickel cadmium, lithium ion… la réaction est réversible. Une pile rechargeable est plus communément appelée accumulateur ou « accu ».
L’invention de la pile est une longue aventure scientifique qui débute avant notre ère, avec la découverte de l’électricité
statique. Elle continue aujourd’hui encore avec l’élaboration de nouveaux procédés pour stocker l’énergie électrique, comme la pile zinc-air qui fonctionne grâce à l’oxygène. Il y a déjà 2600 ans, Thalès (625-547 avant J-C), le philosophe grec, savait attirer des brins de paille avec un morceau d’ambre jaune frotté sur de la laine. Ce sont les propriétés électrostatiques de cette résine fossilisée (ambre se dit en grec « elektron ») qui ont donné naissance au mot électricité. Il a fallu beaucoup de temps aux savants et scientifiques pour percer les mystères de ce phénomène. Pendant plus de 20 siècles, les hommes ne firent que constater l’existence des aimants, de la foudre et de l’électricité statique sans savoir utiliser cette énergie.
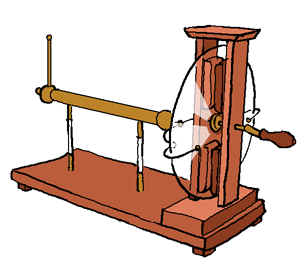
Dès 1600, on savait produire des étincelles en actionnant la manivelle d’un curieux appareil : la machine de Ramsden.
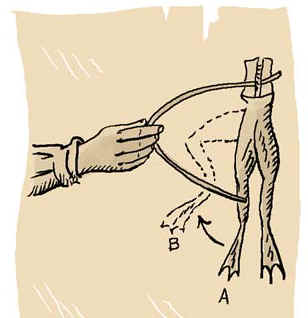
En 1786, Luigi Galvani (1737–1798), un professeur d’anatomie de l’université de Bologne, en Italie, testait les effets des petites décharges fournies par la machine de Ramsden sur le cadavre de grenouilles. Il constata que les muscles des batraciens tressautaient au contact des décharges et fut surpris de voir qu’il obtenait le même résultat en touchant les nerfs des cadavres avec des tiges métalliques. Ne sachant pas expliquer cephénomène, Galvani conclut à l’existence d’une électricité animale.
En 1800, le comte Alessandro Volta (1745–1827), un savant physicien italien, s’intéressa de
près aux expériences de Galvani. Volta pensait que la mise en contact de deux métaux différents produisait de l’électricité. Pour prouver cela, il fabriqua des machines composées de plaques de métaux divers… C’est ainsi qu’il empila les unes sur les autres plus de 60 rondelles de cuivre et de zinc entre lesquelles il intercalait du feutre imbibé d’eau salée. Il fixa aux extrémités de sa pile du fil métallique et réussit, en rapprochant les deux extrémités, à faire une étincelle. Le mot « pile » vient de cet empilement ! Cette pile produisait de l’électricité sans qu’il soit nécessaire de tourner une manivelle. Ce principe est encore celui de nos piles actuelles : deux métaux différents (les électrodes), et un liquide conducteur : l’électrolyte.
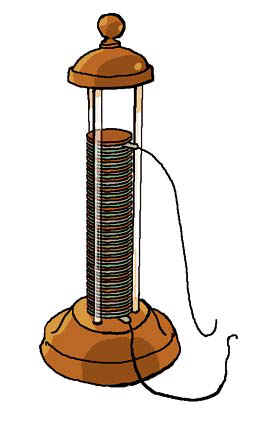
En 1802, le docteur William Cruickshank, de Grande Bretagne, conçut la première pile électrique produite en série.Beaucoup plus simple à fabriquer que la pile Volta, elle fonctionnait avec des plaques de cuivre et de zinc intercalées, baignant dans une solution d’acide dilué. Le tout se trouvait dans une boîte fermée de façon étanche. Cette pile n’était pas rechargeable.

En 1859, le physicien français Gaston Planté inventa la première batterie rechargeable au plomb, selon un principe qui est toujours utilisé de nos jours.
En 1868, le français Georges Leclanché (1839-1882) créa la première pile dite « sèche » : l’électrolyte y était gélifié, ce qui la rendait plus maniable. La pile Leclanché ne nécessitait aucun entretien. Comme le dira la publicité : « Elle ne s'use que si l'on s'en sert ». Dans sa forme moderne,elle est encore actuellement la pile la plus utilisée. Elle est à l’origine de la pile saline au zinc et au bioxyde de manganèse.

En 1899,Waldmar Jungner, un Suédois, inventa la batterie ou accumulateur au nickel-cadmium.
Presque 50 ans après, Neumann réussit à étanchéifier complètement l'accumulateur, ce qui conduisit à la batterie moderne étanche au nickel-cadmium.
Durant la seconde guerre mondiale,Samuel Ruben et Philip Rogers Mallory créent la pile alcaline. Elle possède une plus grande capacité et occupe moins d'espace, ce qui lui permet d’être utilisée dans du matériel transportable consommateur d’énergie : torches électriques, détecteurs de mines et talkies-walkies. De plus, cette pile supporte
des conditions climatiquesextrêmes... Pendant cette période, Mallory a fabriqué des millions de piles au mercure pour les armées.
En 1959, l’américain Lewis Urry conçut lapremière pile alcaline grand public. Ses performances étaient nettement supérieures à celles des piles salines.
En 1970, les premières piles au lithium, qui permettent de remplacer le zinc par un métal plus réducteur, sont mises au point. Parallèlement, les accus au nickel-cadmium et nickel-métal hydrure sont développés pour la technologie spatiale et massivement distribués sur le marché dès 1992.
En 1991, le mercure est définitivement interdit dans la composition des piles. En revanche, il en reste moins d’1% de leur poids dans certaines piles bouton.
Actuellement, on assiste à un développement rapide de la technologie des accumulateurs, notamment ceux au lithium, ou encore des piles à combustible (qui fonctionnent tant qu’on les alimente).
Il existe également des piles Zinc/Air qui, à volume égal, fournissent 5 fois plus d'énergie que les piles habituelles en utilisant l'oxygène de l'air.
Les piles primaires, non-rechargeables, fournissent une quantité d’énergie et de puissance sur une longue durée. De
ce fait, elles sont adaptées pour des appareils d’utilisation occasionnelle.
| La pile saline zinc-charbon (bâton – primaire) 1,5-4,5-6-9 V |
Pour des appareils demandant peu d’énergie avec utilisation sporadique: Exemples d’appareils : Calculatrice, télécommande, réveil, pendule de cuisine, radio portative, lampe torche… |
|
La pile alcaline zinc- manganèse(bâton ou bouton – primaire) 1,5-4,5-6, 9 V |
Pour des appareils consommant beaucoup d’énergie avec utilisation prolongée: Exemples d’appareils : Walkman, lampe torche, flashes, lecteur audio portatif (CD, magnétophone), appareil photo, caméra, jouet, rasoir, téléphone sans fil, voiture télécommandée… |
Les piles rechargeables(ou accumulateurs), fonctionnent comme des piles classiques : elles se déchargent pour produire de l'énergie électrique, épuisant les réactifs. Mais on peut faire passer dans celles-ci le courant en sens inverse avec une source extérieure d'électricité et ainsi les recharger.
Les piles rechargeables fournissent de l’énergie à répétition, mais la durée de leur débit est plus courte. Elles sont donc performantes pour alimenter des appareils utilisés tous les jours et nécessitant une puissance importante. C’est-à-dire une forte quantité d’énergie sur un intervalle de temps court.
| Accus au Nickel-cadmium (bâton – rechargeable) 1,2 V |
Usages domestiques: Exemples d’appareils : Mémoire tampon de l’ordinateur, téléphone sans fil, brosse à dents électrique, éclairage de sécurité, outillage portatif |
| Accus au Nickel-métal-hydrure (rechargeable) 1,2-8,4 V |
Mêmes usages que NiCd mais avec une capacité de charge plus importante: Exemples d’appareils Téléphone sans fil, jouets, jeux vidéo |
| Accus au lithium-ions (rechargeable) 3,7 V |
Accu à grande capacité énergétique: Exemples d’appareils : Téléphones mobiles, caméras numériques, agendas électroniques, véhicules électriques... |
Zinc-carbone (pile saline): La pile saline est la moins performante du marché parce que le couple zinc-charbon fournit peu d’électrons.
Zinc-manganèse (pile alcaline)1 pile alcaline = 5 piles salines
La capacité de cette pile dépend avant tout de la quantité de poudre de zinc présente dans l’anode. La pile alcaline est plus performante que la pile saline et elle perd son voltage régulièrement. Malheureusement,
la plupart des appareils cessent de fonctionner lorsque le voltage tombe en dessous de 1,1 V, ce
qui explique qu’on puisse mettre de côté des piles qui ne « marchent » plus mais ne sont pas entièrement déchargées… On peut récupérer ces piles en les utilisant dans des appareils moins « gourmands » !
Lithium
Ces piles ont les mêmes capacités que les piles alcalines mais leur voltage ne chute que lorsque la pile est vraiment vide, ce qui allonge considérablement leur durée de vie. En fin de charge, elles s’épuisent très vite.
Nickel-cadmium
Ces accumulateurs présentent une tension constante jusqu’à épuisement de la charge. En revanche, ils se déchargent seuls si on ne les utilise pas. Il vaut mieux s’en servir dès qu’on les a rechargés, ce que l’on peut faire environ 1000 fois. Afin d’éviter toute pollution et d’économiser ces métaux, il faut absolument collecter et recycler ce type d’accumulateurs.
Nickel-métal hydrure
À taille égale, ces accus sont encore plus performants que les accus Ni-Cd. En revanche, ils se déchargent une fois et demi plus vite et peuvent êtres rechargés seulement 500 fois.
Cette pile est la plus courante dans le commerce.
Les piles cylindriques les plus utilisées sont en vente en sept formats dans le commerce.
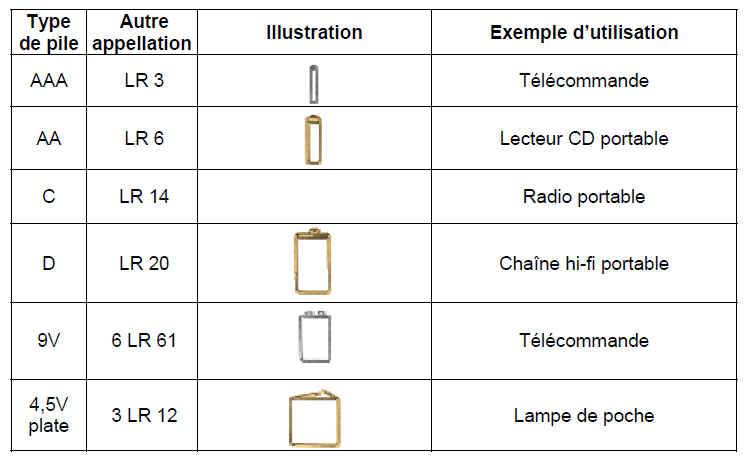

Ces piles ont la forme d’un bouton, d’où leur nom, elle sont rondes et plates, souvent d’un diamètre supérieur à
leur hauteur. Elles sont surtout utilisées pour des appareils qui ont besoin d’une source d’énergie de petite taille, légère et performante.
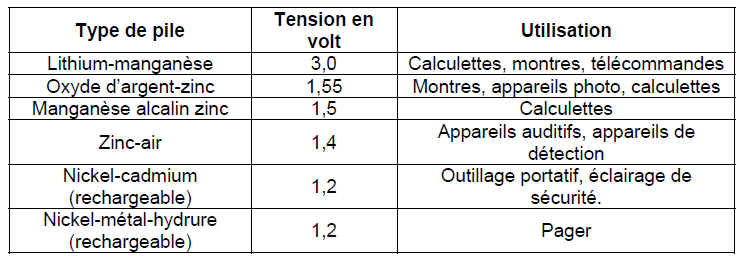
Sur les piles ou leurs emballages, on distingue des lettres et des chiffres : AAA, LR6, AA, C, D, 9V... Selon le code auquel se réfèrent ces indications, on obtient des renseignements sur la composition et/ou la forme de la pile :
Le code ANSI (American National Standard Institute) fait référence aux dimensions des piles.
Le code IEC (International Electrotechnical Commission) décrit la composition et la dimension des piles.


La pile zinc/charbon saline ou pile Leclanché (primaire - bâton) :
•Avantages :Ce type de pile est deux fois moins cher que les piles alcalines.
•Inconvénients :Elle a une capacité de stockage limitée et ne dure pas longtemps. Elle ne peut être utilisée que dans des appareils qui ne
consomment pas beaucoup d’énergie et d’utilisation sporadique (calculette, télécommande, réveil, pendules de cuisine, radios portatives, lampe de
poche...).
La pile zinc/manganèse alcaline (primaire - bâton, bouton)
•Avantages :Très performante, elle a une longue durée de vie. On estime que, selon les appareils, une pile alcaline peut remplacer 3 à 5 piles
zinc/charbon. Elle est particulièrement adaptée pour les appareils utilisés régulièrement et exigeant des performances continues comme les walkmans, les lampes torches, les flashes, les lecteurs audio portatifs (CD,magnétophones, mp3), les appareils photo, les caméras, les jouets, les rasoirs, les téléphones sans fil...
Une pile alcaline conserve90 % de sa capacité pendant plus de deux ans si elle n’est pas utilisée.
Les piles alcalines et salines représententplus de 80 % des piles vendues sur le marché.
La pile zinc /air(primaire - bouton)
•Avantage : c’est une pile spéciale ayant une grande capacité de charge
•Inconvénient : elle est principalement destinée aux appareils auditifs (mais aussi aux parcmètres et
aux clôtures électriques).
La pile à oxyde d’argent(primaire - bouton) est la plus utilisée des piles bouton :
•Avantages : elle débite un faible courant pendant longtemps et est employée dans les calculatrices, les montres, les pacemakers, les appareils auditifs, les gadgets... Elle est de très petite taille.
•Inconvénient :son coût de fabrication est élevé.
La pile au lithium(primaire - bouton)
•Avantages : c’est une grande pile bouton, ou bâton, légère, très plate et très performante, utilisée dans les montres, les balances, les calculettes mais aussi dans des appareils demandant beaucoup d'énergie comme les flashes.
Les piles au lithium ne connaissent quasiment pas le problème du déchargement dans le temps lorsqu’elles ne sont pas utilisées.
•Inconvénient : Regroupées en très grandes quantités sans protection, les piles au lithium sont sensibles à l’inflammation car le lithium est une matière instable au contact de l’eau ou de l’air.
Les accumulateurs NiCd utilisent principalement deux métaux : le nickel et le cadmium. Ils sont utilisés dans deux types de produits : les batteries
industrielles (trains, aviation, éclairage de secours...),et les accumulateurs rechargeables, grand public (téléphones portables, couteaux électriques, perceuses sans fil, aspirateurs, caméras..). L'ensemble représente, en France, de l'ordre de
3300 tonnes par an de batteries au nickel/cadmium, dont 375 tonnes de cadmium.
Les accumulateurs au nickel-cadmiumNiCd (secondaire - bâton).
•Avantages : Ils conviennent pour la plupart des usages domestiques : les téléphones sans fil, les brosses à dents électriques, les outils à accumulateur, les éclairages de sûreté. Robustes, ils ont une durée de vie particulièrement longue et sont rechargeables jusqu’à 1000 fois.
•Inconvénients : Ils contiennent une part importante de cadmium (15 à 20% du poids de la pile) qui est un métal lourd et donc potentiellement polluant. Mais le cadmium sera prochainement
interdit par décret dans la composition des piles à partir de 2007, à l’exception importante des accus utilisés dans les outils éléctroportatifs. De plus,
leur durée de vie est moins longue que celle des piles rechargeables NiMH.
Les accus de ce type doivent toujours être entièrement déchargés avant d’être rechargés à cause de l’effet mémoire (lien hypertexte vers lexique).
Les accumulateurs au nickel-métal-hydrure NiMH
•Avantages :Ils ont une puissance énergétique qui dépasse de 20 à 30% celle des piles rechargeables à base de cadmium et sont moins polluants. Ils sont bien adaptés pour des applications de faible puissance (téléphonie, jouets, jeux) car ils se rechargent jusqu’à 1 000 fois. Ils ne présentent pas d’effet mémoire et peuvent être rechargés avant décharge complète, sans que cela ne réduise leur capacité maximale.
•Inconvénients : Plus chers que les accus au nickel-cadmium à l'achat. Ils ne sont pas assez performants pour l’outillage électroportatif (perceuses,
visseuses…).
Les accumulateurs au lithium-ion sont les représentants d’une nouvelle génération de piles rechargeables. Ce sont des piles boutons ou bâtons très performantes.
•Avantages : Ils offrent les plus hautes performances même lorsqu’ils ne sont pas utilisés durant plusieurs mois. Ils sont utilisés par exemple dans les
téléphones et les ordinateurs portables ainsi que dans les appareils photo numériques, les caméscopes, les véhicules électriques, etc.
•Inconvénient : Coûteux à l’achat, ils se chargent sur l’appareil proprement dit et pas sur un chargeur. Contrairement aux autres accus, ces systèmes ne se déchargent spontanément que très peu,
Les piles ne sont pas dangereuses lors de leur utilisation mais, une fois usées, ce ne sont pas des déchets comme les autres. Elles peuvent devenir toxiques lorsqu’elles sont rejetées avec les déchets ménagers habituels. Mieux vaut donc les recycler.
Rappel des objectifs de la collecte et du recyclage des piles :
• Economiser les ressources naturelles de métaux entrant dans la composition des piles : zinc, manganèse,cadmium… Récupérer ces matières
premières et les réintroduiredans le circuit de fabrication des piles, c’est agir pour le développement durable.
• Diminuer le volume des ordures ménagères, véritable enjeu écologique pour notre planète.
• Éviter le risque potentiel de pollution quand les piles sont rejetées dans la nature
Les métaux les plus courants utilisés dans les piles sont le manganèse et le zinc. Bien que les réserves mondiales de ces deux matériaux ne soient pas en voie d’épuisement, les économies réalisées en terme d’extraction et de transport grâce au recyclage des piles ne sont pas négligeables.
Par ailleurs, les filières de recyclage,bien organisées, de plus en plus performantes, ne recyclent qu’un tiers des piles vendues sur le marché. Un autre tiers reste stocké chez les consommateurs tandis que le dernier tiers est jeté dans les déchets ménagers… Il en va de la responsabilité de chacun, aujourd’hui, d’« alimenter » ces filières en rapportant les piles et les petits accus usagés et ainsi de renverser ces proportions
insatisfaisantes.
Enfin, le volume des déchets ménagers ne cesse d’augmenter de 1% par an : on jette aujourd’hui environ 1,2 kilos d’ordures par personne et par jour, c’est-à-dire 438 kilos par personne et par an (le poids d’un cheval…), soit un peu plus de 26 millions de tonnes par an
pour la population française !… Au regard de cette quantité d’ordures
ménagères, les 30 000 tonnes de piles et accus vendues par an ne correspondent qu’à 1/1000eme de cette masse. Les piles n’étant pas des déchets comme les autres, il est préférable de les trier de nos ordures et de les traiter spécifiquement. Seuls les recycleurs dédiés à ce type de déchets sont capables de traiter la toxicité des fumées dégagées lors de leur incinération, de même qu’ils sont compétents pour récupérer et redistribuer les différents matériaux composant les piles.
Le mercure, associé à d'autres matériaux, a longtemps été utilisé sous forme d'oxyde de mercure pour faire office d'électrode positive, tant parce qu'il est un excellent conducteur de courant électrique que parce qu'il protège l'électrode de la corrosion.
À partir de la seconde moitié des années 1990, la plupart des producteurs européens ont renoncé à utiliser le mercure dans la fabrication des piles au manganèse alcalin ou au zinc-carbone. Depuis l’an 2000, des solutions plus écologiques (comme la pile bouton zinc-air) ont même remplacé les piles boutons à l’oxyde de mercure, elles sont utilisées pour leurs hautes performances dans les appareils auditifs.
Le mercure limite la formation d’hydrogène dans les piles et évite ainsi de les faire gonfler.
Les piles salines et alcalines ne contiennent donc plus de mercure depuis 1991. Quant aux piles bouton, qui en contenaient plus d'un tiers de leur poids, elles n’en contiennent aujourd'hui que 0,5 à 1% de leur poids...
Le recyclage fait appel à trois grands types de procédés, selon les catégories de piles à recycler.
• La pyrométallurgie (pour 90 % des piles bâton)
Ce procédé concerne surtout les piles salines et alcalines. Les piles sont introduites dans un four dont la température atteint 1500 °C.
Grâce aux différentes températures d'évaporation des métaux, les divers composants de la pile vont êtres
séparés par condensation. Les métaux qui ont un point d'évaporation bas comme le mercure, le zinc, le cadmium ou le plomb s'évaporent et sont récupérés après lavage des fumées.
• L’hydrométallurgie
Ce procédé concerne également les piles alcalines et salines ainsi que les accumulateurs lithium. Pour ce procédé, les piles et les batteries usagées sont préalablement broyées puis triées afin de séparer les éléments métalliques des éléments organiques. Puis les métaux sont soumis à une attaque chimique en milieu alcalin ou acide. Cette technique utilise peu d’énergie et beaucoup de réactifs, mais ne pollue pas l’atmosphère et nécessite un traitement chimique complémentaire pour aboutir à des métaux réutilisables.
• La pyrolyse
Ce procédé est réservé aux piles bouton, aux accumulateurs NiCd et Ni MH et consiste en la distillation de celles-ci. Les piles sont placées sous une cloche chauffante portée à 600 °C. Cette technique permet notamment de récupérer le mercure encore contenu dans les piles boutons.
Grâce au traitement des piles et des accumulateurs, divers matériaux peuvent êtres valorisés en vue de leur réutilisation dans l'industrie.Viennent en priorité le ferromanganèse et le zinc, ces substances présentent un degré élevé de pureté et sont vendues pour être réutilisées
comme matières premières. Le ferromanganèse sert d'alliage dans la fabrication de l'acier, le zinc est remis sur le marché mondial par les fournisseurs de métaux.
Quant aux matières plastiques, elles sont éliminées au cours du processus avec l'exploitation simultanée de leur potentiel énergétique (valorisation thermique, voir lexique). Seule une petite fraction (env. 5%) est traitée dans des centres d’incinération de déchets spéciaux en tant que résidu chimique solide.
Ce que deviennent les différents produits récupérés :
•Le zinc est notamment transformé en gouttières et toitures.
•Le manganèse peut-être réutilisé pour des peintures anti-rouille.
•Le mercure sert dans des applications industrielles spécifiques et pharmaceutiques
•L'acier, une fois refondu, permet par exemple de fabriquer des carrosseries de voitures.
•Le laitier est une matière minérale qui sert à remblayer les routes et à fabriquer de la laine de roche, un isolant phonique.
•Le fer et le manganèse, sous forme de ferromanganèse, sont souvent utilisés dans la coutellerie de luxe ou pour fabriquer les dents des pelleteuses…

Participer à la réduction du volume des déchets ménagers par la collecte des piles usagées et permettre la valorisation de matières premières non renouvelables en favorisant le recyclage des piles est possible à l’échelle de chaque individu.
Par ailleurs, avant de porter une pile jusqu’à un lieu de collecte, vérifier qu’elle est vraiment déchargée et ne peut être utilisée dans un appareil moins
« gourmand » ! Ainsi, une pile hors d’usage dans un baladeur ou une lampe peut s’avérer encore efficace dans une pendule ou une télécommande.
L’effet mémoire : lorsqu’un accumulateur NiCd a été rechargé à de nombreuses reprises alors qu’il n’était pas complètement déchargé, il «se souvient» de ce niveau de charge plus faible et réduit d’autant sa capacité.
La collecte sélective : Récupérer un déchet, c'est le sortir de son circuit traditionnel de collecte et de traitement. Par exemple, mettre des bouteilles ou des journaux dans un conteneur spécial, au lieu de les jeter à la poubelle. La récupération, qui suppose une collecte séparée ou un tri, se situe
en amont de la valorisation qui consiste, d'une certaine façon, à redonner une valeur marchande à ces déchets. La valorisation s'effectue par divers moyens.
Le recyclage: c’est la réintroduction directe d'un déchet dans le cycle de production dont il est issu, en remplacement total ou partiel d'une matière première neuve.
Le réemploi est l’utilisation d’un déchet pour un usage identique à sa vocation première. C'est, en quelque sorte, prolonger la durée de vie du produit avant qu'il ne devienne un déchet. Par exemple, la consigne des bouteilles, à nouveau remplies après leur nettoyage.
La réutilisation consiste à utiliser un déchet pour un usage différent de son premier emploi, ou à fabriquer, à partir d'un déchet, un autre produit que celui qui lui a donné naissance. Par exemple, utiliser des pneus de voiture pour protéger la coque des barques ou chalutiers.
La régénération est un procédé physique ou chimique qui redonne à un déchet les caractéristiques permettant de l'utiliser
en remplacement d'une matière première neuve. C'est le cas, par exemple, de la régénération des huiles usées ou des solvants, ou du papier qui est à la
fois recyclé et régénéré par le désencrage.
La valorisation énergétique consiste à utiliser les calories contenues dans les déchets, en les brûlant et en récupérant l'énergie ainsi produite pour, par exemple, chauffer des immeubles ou produire de l'électricité.
Le développement durable : ce concept a été défini en 1987 à la suite d’un constat : si le développement des activités humaines est uniquement motivé par la création de richesses, accentuant les différences entre les riches et les pauvres et au détriment des ressources naturelles de notre planète, alors
ce développement ne pourra pas se poursuivre éternellement. Un développement durable est un développement qui s'efforce de répondre aux besoins du présent sans compromettre la capacité des générations futures à répondre à leurs besoins. L'enjeu est double :
solidarité entre les générations (préserver les ressources et l'état de la planète pour ceux qui viendront après), mais également entre les
peuples (partager les richesses et ne pas laisser se creuser les écarts entre riches et pauvres, Nord et Sud).
Les métaux lourds(plomb, mercure, cadmium…) sont les éléments métalliques de masse volumique élevée (supérieure à 5 grammes par cm3)
présents naturellement - mais en quantités très faibles - dans les sols, l’eau et l’air. Ce sont les seuls métaux à avoir des propriétés chimiques et électriques intéressantes.